7 FORSCHUNG UND METHODEN
VOM GEN ZUM PROTEIN
VOM GEN ZUM PROTEIN
Die Zelle (lat. cellula: kleine Kammer) ist die kleinste Einheit des Lebens. Sie kann sich teilen und vermehren, sie hat einen Stoff- und Energieumsatz und kann wachsen. Zellen können Reize aus der Umgebung wahrnehmen und sich an die Umwelt anpassen.
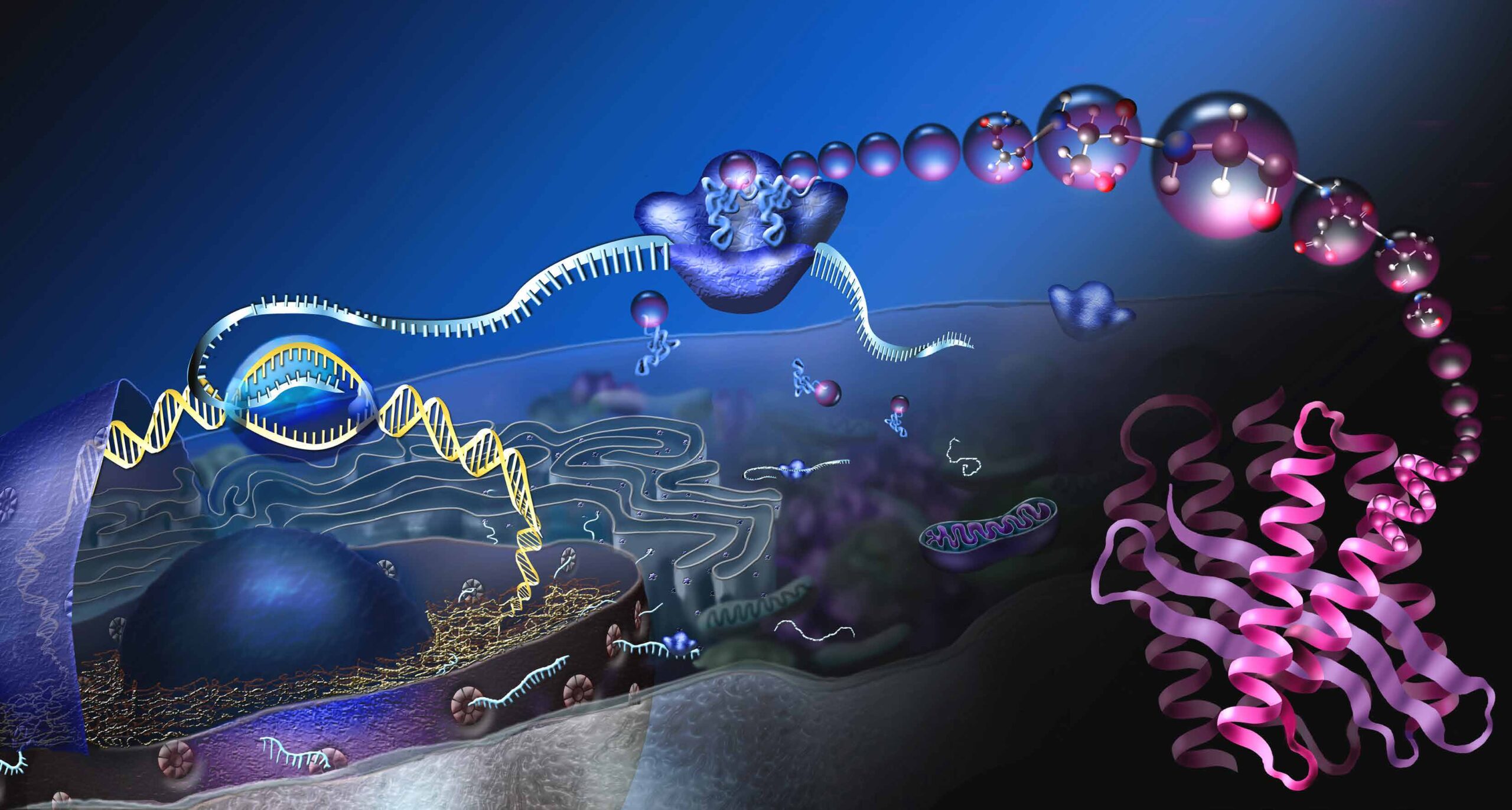
Die Grafik zeigt eine sogenannte eukaryotische Zelle und den Prozess der Proteinherstellung. Im Zellkern A befindet sich die Erbinformation, auch Desoxyribonukleinsäure (DNA) genannt. Die DNA speichert den Aufbau unserer Proteine. Für die Herstellung eines bestimmten Proteins wird ein Abschnitt auf der DNA, ein Gen, abgelesen B. Die Abschrift wird als Messenger-RNA (mRNA) bezeichnet und gelangt über Kernporen in das Zellplasma C. An den Proteinfabriken, den Ribosomen, wird die mRNA in Proteine übersetzt D. Drei Grundbausteine der mRNA verschlüsseln eine bestimmte Aminosäure. Sogenannte Transport-RNAs liefern die Aminosäuren an E, die Grundbausteine der Proteine. An den Ribosomen werden die Aminosäuren miteinander verknüpft und lange Proteinketten entstehen F. Damit aus den Proteinketten funktionelle Moleküle werden, müssen sie sich in spezifische, dreidimensionale Formen falten G.
ANALYSEMETHODEN
ANALYSEMETHODEN
Für die Untersuchung biochemischer Prozesse und Makromoleküle, sprich Proteine, DNA, RNA oder Kohlenhydrate, nutzen unsere Forschenden routinemäßig Methoden und Techniken aus dem Bereich der klassischen Chemie, Physik, Molekularbiologie, Mikrobiologie, Biotechnologie und auch der Informatik. Sie interessieren sich für den Aufbau der Moleküle, deren Funktionsweise und Zusammenspiel auf molekularer oder zellulärer Ebene sowie ihre Rolle in einem Organismus. Je nach Analyseverfahren werden Biomoleküle, wie Proteine, erst aus Zellen extrahiert. Mit Hilfe verschiedener Trennverfahren wie Zentrifugation, Gelelektrophorese oder Chromatographie können Zellaufschlüsse dann nach ihren Eigenschaften, wie ihrer Größe oder Ladung, getrennt werden. Damit bestimmte Moleküle im Mikroskop sichtbar sind, können diese auf verschiedene Arten markiert und bestimmte Strukturen gefärbt werden. Die Gentechnik ermöglicht die gezielte Herstellung oder Manipulation von Proteinen.
Für die erfolgreiche Forschung ist der Methodenservice durch sogenannte Facilities eine wichtige Säule am Institut. Diese zentralen Einrichtungen unterstützen alle Abteilungen mit ihrer Fachexpertise. Dazu gehören unter anderem ein Chemieservice, DNA-Sequenzierungs-, Mikroskopie-, Proteinherstellungs- sowie Analyseservice.
METHODENENTWICKLUNG
METHODENENTWICKLUNG
Um die Grenzen des Wissens zu erweitern, beinhaltet auch die Grundlagenforschung immer eine Verbesserung und Neuentwicklung von Methoden und Technologien. Von Anfang an gab es am MPI Abteilungen, die ihren Schwerpunkt auf die Methodenent- wicklung legten: So leitete Kurt Hannig die Abteilung biochemische Arbeitsmethoden. Sein Team entwickelte ein Trennverfahren für Zellen und Zellorganellen. Pehr Edmann wurde für seine Proteinsequenzierungsmethode bekannt.
Wolfram Zillig gilt als ein Vater der molekularen Genetik. Sein Team entwickelte die „Phenolmethode“ zur Reinigung von Nukleinsäuren, die bis heute zur täglichen Praxis in der ganzen Welt gehört. Sie etablierten auch erstmals ein Protein-Biosynthese- System des Bakteriums Escherischia coli im Reagenzglas. Peter Hans Hofschneider, Pionier der Molekularbiologie, untersuchte in seiner Abteilung Bakteriophagen – Viren, die Bakterien befallen. Gemeinsam mit anderen Arbeitsgruppen wurde die Phage M13 (München 13) als einer der ersten Klonierungsvektoren verwendet. Vektoren, lat. für Träger, werden in der Gentechnik genutzt, um fremde Erbinformation in eine lebende Empfängerzelle zu übertragen.
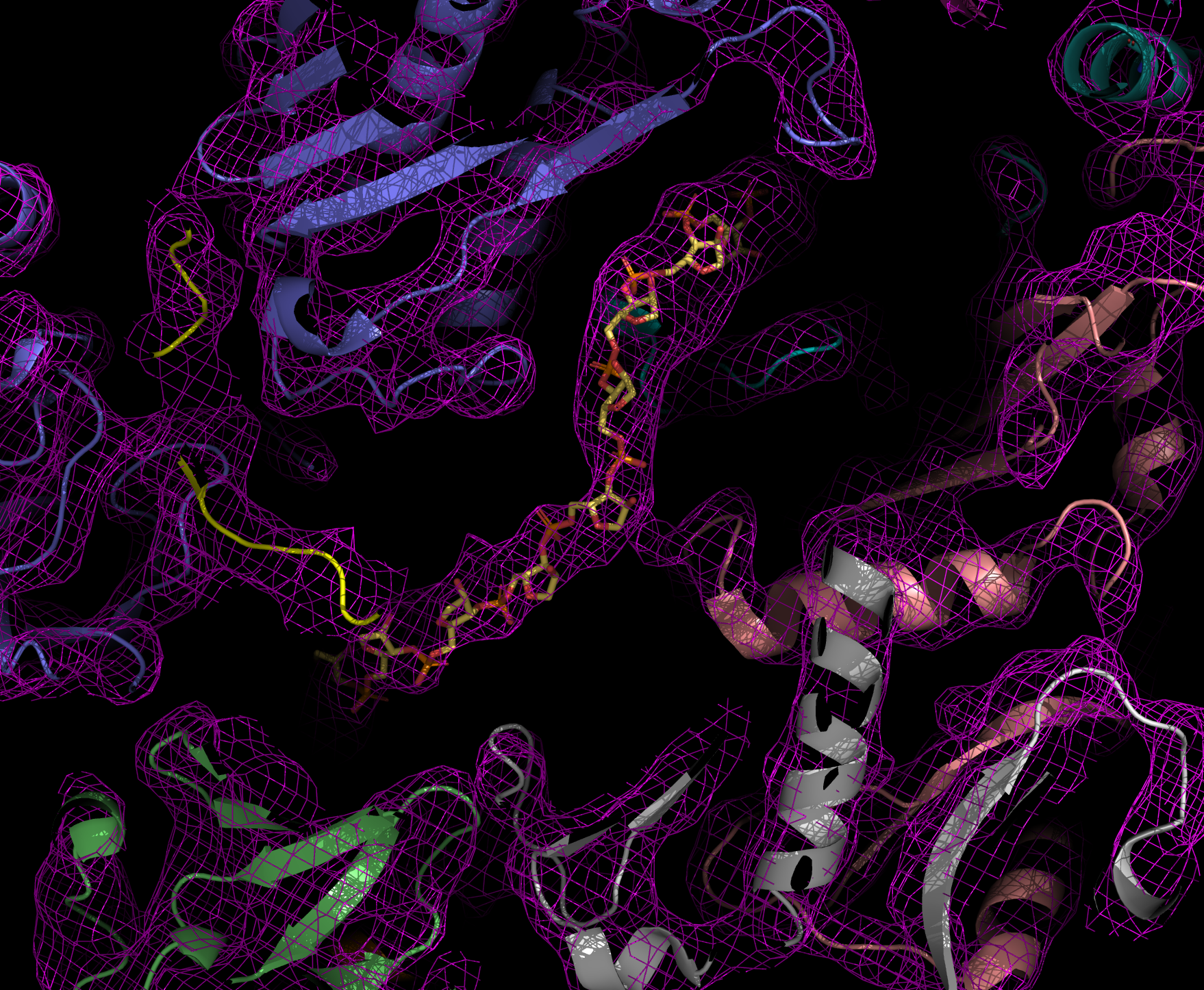
ANALYSE DES PROTEINAUFBAUS
ANALYSE DES PROTEINAUFBAUS
ANALYSE DES PROTEINAUFBAUS
Walter Hoppe, ehemaliger Direktor der Abteilung Strukturforschung, war einer der Pioniere der Röntgenkristallographie in Deutschland. Später entwickelte er aber auch Visionen, wie die Elektronenmikroskopie zur dreidimensionalen Strukturanalyse von Proteinen genutzt werden könnte. Mithilfe der Röntgenstrukturanalyse wird der atomare Aufbau eines Protein-Kristalls bestimmt. Um zu kristallisieren, müssen Proteine sehr rein vorliegen und sich regelmäßig anordnen. Beim Durchleuchten der Kristalle mit Röntgenstrahlen werden die Strahlen gebeugt. Das Beugungsmuster erlaubt Rückschlüsse auf die Struktur der Proteine.
Dank dieser Methode gelang Robert Huber, Hartmut Michel und Johann Deisenhofer die Aufklärung des dreidimensionalen Aufbaus des Reaktionszentrums der Photosynthese bei einem Bakterium, die später mit dem Nobelpreis gewürdigt wurde. Auch die Abteilung Zelluläre Strukturbiologie, geleitet von Elena Conti, nutzt die Proteinstrukturanalyse, um den Aufbau und die Funktion des Exosoms und seiner Interaktionspartner zu verstehen. Das Exosom ist eine molekulare Maschine, die RNA- Moleküle in den Zellen abbaut.
KRYO-ELEKTRONEN-MIKROSKOPIE
KRYO-ELEKTRONEN-MIKROSKOPIE
Im Gegensatz zur Röntgenstrukturanalyse ist es bei der Kryo-Elektronenmikroskopie (Kryo-EM) nicht notwendig, Proteinkristalle herzustellen. Viele Proteine sind sehr instabil oder bilden keine Kristalle. Die Proteine bleiben in ihrer natürlichen Form erhalten. Die Einzelpartikelanalyse wurde in den letzten Jahren zu einer leistungsfähigen Methode der hochauflösenden Proteinstrukturanalyse entwickelt. Sie eignet sich vor allem für große Molekülkomplexe, wie das 26S Proteasom, ein riesiger, aus 34 verschiedenen Untereinheiten aufgebauter Komplex, der für den gezielten Abbau von nicht mehr benötigten Proteinen verantwortlich ist.
Für die Kryo-EM werden Proteine auf unter -150°C schockgefrostet. So gefriert das Wasser in den Proben zu einer glasklaren Masse ohne Eiskristalle. Die Proben werden anschließend mit einem Elektronenstrahl aufgenommen. Mithilfe von Computern werden aus vielen verschiedenen Momentaufnahmen einzelner Proteine hochaufge- löste 3D-Bilder errechnet. Wolfgang Baumeister gilt als der Pionier der Kryo-Elektro- nentomographie, mit der die molekulare Architektur von Zellen in hoher Auflösung (< 1nm) untersucht werden kann. Die Abteilung von John Briggs nutzt diese Methode, um umhüllte Viren zu untersuchen.

UBIQUITINE – KLEINE PROTEINE MIT GROSSER WIRKUNG
UBIQUITINE – KLEINE PROTEINE MIT GROSSER WIRKUNG
Ubiquitin ist ein kleines Protein, das andere Proteine markiert, um ihr weiteres Ver- halten zu steuern. Es war seit Jahren bekannt, dass eine Art von Ubiquitin-Markierung Zielproteine zum „Proteinschredder“, dem Proteasom, leitet, wo sie abgebaut werden. Stefan Jentsch entdeckte, dass die Ubiquitin-Kennzeichnung auch anderen wichtigen Zwecken dient, wie etwa der Steuerung der DNA-Reparatur.
Heute wissen wir, dass Ubiquitine und mehrere Ubiquitin-ähnliche Proteine (UBL) den Zeitpunkt, den Aufenthaltsort, die Zusammensetzung, die Konformation und die Aktivitäten tausender verschiedener Proteine und Makromoleküle in den Zellen steuern. Defekte in Ubiquitin- und UBL-Reaktionswegen führen zu zahlreichen Krankheiten wie Krebs, neurodegenerativen Störungen und Virusinfektionen.
Brenda Schulman und ihr Team haben herausgefunden, wie Ubiquitin- und UBL-Mar- kierungen durch große, dynamische Molekülverbände genau an die richtigen Proteine geliefert werden.
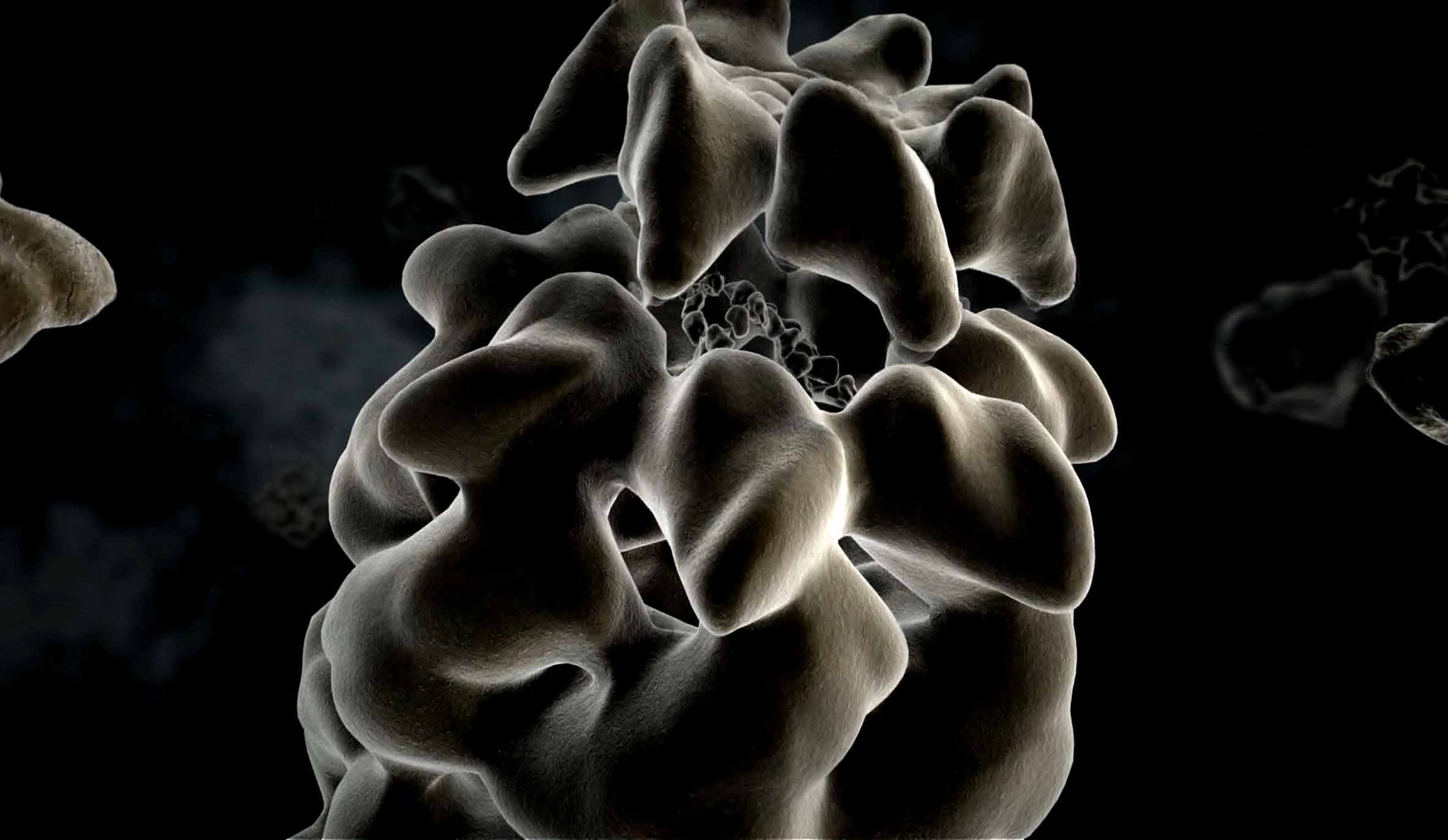
PROTEINFALTUNG
PROTEINFALTUNG
Es gibt unzählige Möglichkeiten, wie Aminosäureketten zu Proteinen gefaltet
werden können, doch nur eine ist die richtige, die garantiert, dass ein Protein seine Aufgaben erfüllt. „Zelluläre Anstandsdamen“, Chaperone, sorgen für die korrekte Proteinfaltung und helfen, dass die richtigen Aminosäurestränge eines gerade hergestellten Proteins zueinander finden – eine Entdeckung von F.-Ulrich Hartl und sein Forschungsschwerpunkt bis heute. Chaperone können eventuell sogar entstandene Fehlfaltungen korrigieren. Geschieht dies nicht, können die Proteine verklumpen, sich in Zellen ablagern und sie schädigen. Neurodegenerative Krankheiten wie Alzheimer, Parkinson oder Chorea Huntington können die Folge sein. Für das Verständnis dieser Krankheiten ist die Erforschung von Chaperonen so wichtig.
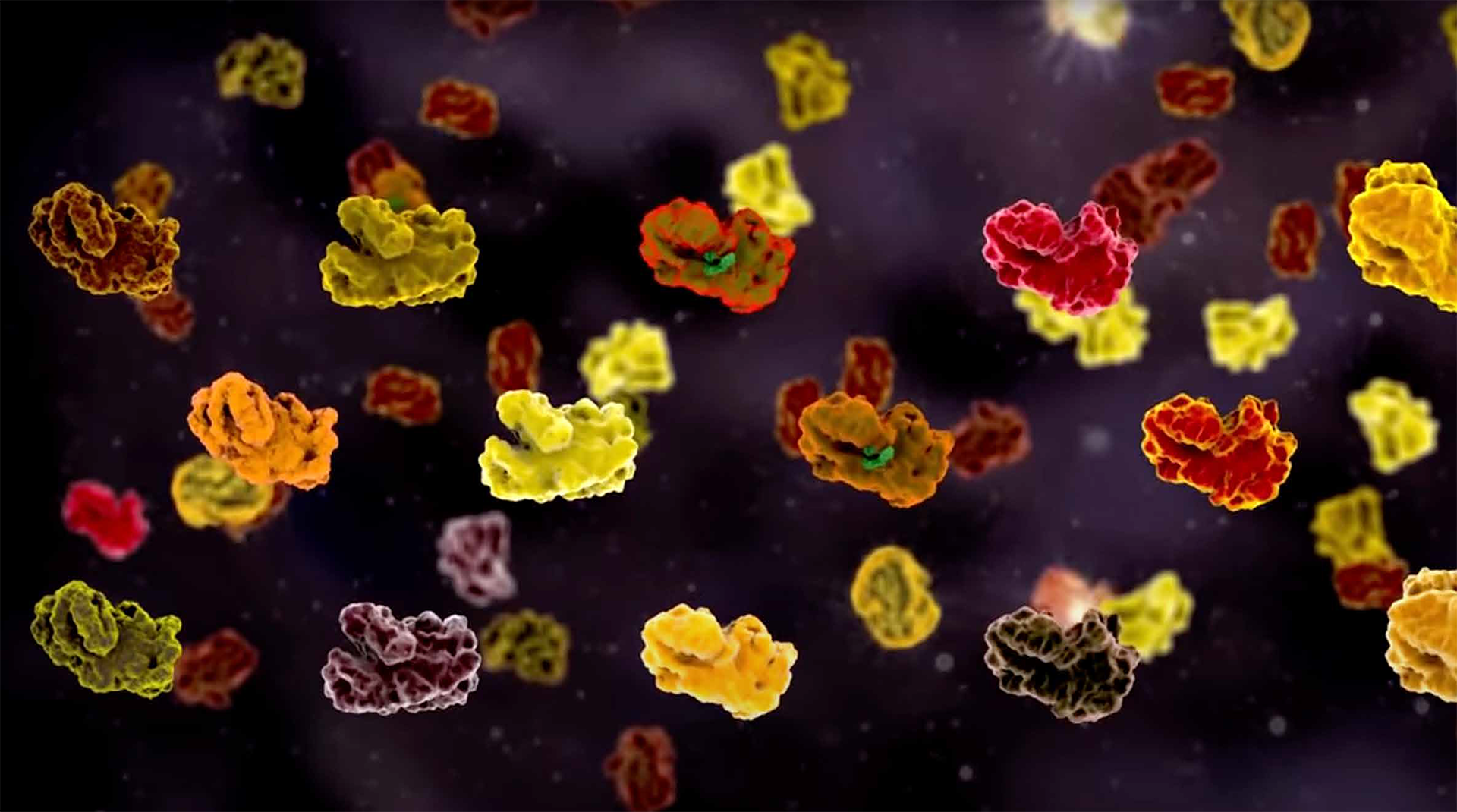
DAS PROTEOM
DAS PROTEOM
Im Gegensatz zum Genom ist das Proteom eines Organismus – also die Gesamtheit aller Proteine – nicht für alle Zellen gleich: Jeder Zelltyp hat eine spezifische Proteinausstattung. Auch innerhalb der Zelle ist das Proteininventar variabel, denn Proteine werden permanent gebildet, verändert oder entsorgt. Diese dynamischen Prozesse untersuchen Matthias Mann und seine Mitarbeiter*innen mit Hilfe der Massenspektrometrie. Mittlerweile hat das Team die Massenspektrometrie so weit optimiert, dass ihre Nutzung in der medizinischen Diagnostik immer weiter in den Fokus rückt. So können mit dieser Methode die Proteine, z. B. aus einem Blutstropfen, identifiziert und so der allgemeine Gesundheitszustand überprüft werden. Da die Proteomforschung von Matthias Mann so viele Bereiche in der biologischen und medizinischen Fachwelt beeinflusst, ist er mit seinen wissenschaftlichen Veröffentlichungen weltweit einer der meistzitierten Wissenschaftler.
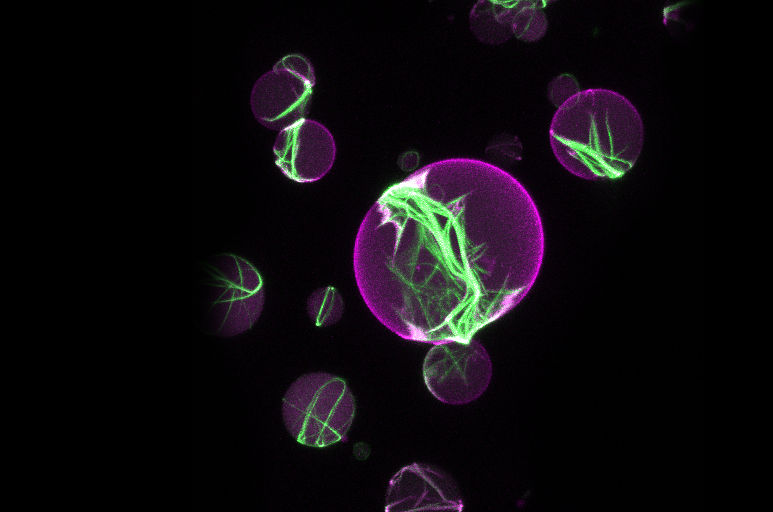
ZELLTEILUNG
ZELLTEILUNG
Die Zellteilung ist eine Grundeigenschaft des Lebens. Als Biophysikerin untersucht Petra Schwille mit einem synthetisch-mechanistischen Ansatz, welche Proteine für die Zellteilung essentiell sind. Die Gruppe konnte zeigen, dass das Zusammenspiel von nur fünf Proteinen zur Ausbildung einer Teilungsringstruktur in der Mitte eines Fettbläschens (Liposom) führt – ein möglicher erster Schritt zur Nachbildung der Zellteilungsmaschinerie für künstliche Zellen im Reagenzglas.
Erich Nigg erforschte die Mitose, also den Prozess der Kern- und Zellteilung. Sein Team untersuchte, welche Mechanismen die Mitose zeitlich und räumlich regulieren und wie eine fehlerfreie Teilung gewährleistet wird. Störungen dieser Prozesse werden für die Entstehung von Krebszellen verantwortlich gemacht.
Auch Axel Ullrich hat sich mit der Entstehung von Krebszellen beschäftigt. Mit seinem Team hat er Wachstumsfaktor-Rezeptoren auf Zellen und damit die Signalwege untersucht, die Zellen zur Teilung anregen. Die gezielte Blockade der überaktivierten Signalwege hemmt die Zellteilung – die Grundlage für bestimmte Krebsmedikamente.
DER BEGINN DES LEBENS
DER BEGINN DES LEBENS
DER BEGINN DES LEBENS
Die Abteilung von Kikuë Tachibana untersucht die Mechanismen der Umprogrammierung von totipotenten Zellen – also von Zellen, die sich in alle Zelltypen und einen ganzen Organismus entwickeln können. Diese Zellen entstehen nach der Befruchtung einer Eizelle durch ein Spermium. Die mütterlichen und väterlichen Erbinformationen werden neu vereint. Nach der Befruchtung liegt die kombinierte Erbinformation noch inaktiv im Zellkern vor. Während die erste Teilung der befruchteten Eizelle noch mit Hilfe der in ihrem Inneren eingelagerten mütterlichen Faktoren funktioniert, ist für die weitere Entwicklung eines Embryos die Synthese neuer embryonaler Produkte notwendig. Welche Faktoren für das Öffnen der DNA zuständig sind, hat Kikuë Tachibanas Team erst kürzlich entdeckt. Viele Fragen zur molekularen Aktivierung und Umstrukturierung der totipotenten Zellen sind noch nicht beantwortet. Sie werden die Abteilung in den nächsten Jahren intensiv beschäftigen.
DER ZWISCHENZELLRAUM
DER ZWISCHENZELLRAUM
Die extrazelluläre Matrix (EZM) ist der Bereich zwischen den Zellen. Die Substanzen und Fasern, die sich in den Zwischenräumen befinden, halten alle Gewebe in mehr- zelligen Organismen zusammen. Klaus Kühn, Mitbegründer der Bindegewebs- forschung, entschlüsselte mit seinem Team den Aufbau von Kollagenfasern, einem wichtigen Bestandteil der EZM, enthalten in Haut, Sehnen, Knochen und Knorpel. Kühn ermittelte die genaue Abfolge der drei ineinander verdrehten Aminosäure-Ketten, aus denen das Kollagen I-Protein besteht.
Weitere wichtige Komponenten der EZM sind Laminine – kollagenähnliche Proteine, die Bindungsstellen zu Zelloberflächenrezeptoren aufweisen. Rupert Timpl isolierte Laminine und klärte ihre Struktur auf. Er gilt als Begründer der modernen Basal- membran-Forschung, die für die Entwicklungsbiologie sowie die Diagnose und Behandlung von vielen Erkrankungen bahnbrechend war. Reinhard Fässlers Team erforscht die Funktionsweise der Integrine – Rezeptorproteine, die in die Zellmembran eingebettet sind und in die EZM ragen. Integrine können biochemische Signale auslösen und mechanische Signale sowohl übermitteln als auch empfangen. Sie beeinflussen die Zellteilung oder die Zellwanderung, die etwa bei der Blutgerinnung und der Immunabwehr eine wichtige Rolle spielen.
ARCHAEEN – DIE EXTREMEN
ARCHAEEN – DIE EXTREMEN
Ab den 1970er Jahren war Wolfram Zillig fasziniert von dem neu entdeckten Urreich der Lebewesen, den Archaea. Diese einzelligen Organismen bilden neben Bakterien und Eukaryoten (Organismen mit Zellkern) eine dritte Domäne des Lebens. Sie besiedeln Standorte mit extremen Lebensbedingungen, wie siedend heiße Quellen oder Habitate mit extrem hohem Salzgehalt. Zilligs Team zeigte, dass eine große Ähnlichkeit bei der Genexpression zwischen Archaea und Eukaryoten existiert, während Stoffwechselgene der Eukaryoten mehr den bakteriellen Genen entsprechen. So formulierte Wolfram Zillig die Hypothese, dass die Eukaryoten durch eine Fusion von Bakterien und Archaea entstanden sind.
Dieter Oesterhelt interessierte sich für das salzliebende Archaeon Halobacterium salinarium. Anfang der 1970er Jahre wies er Retinal in der Zellmembran des Archae- bakteriums nach. Als Bestandteil des Proteins Rhodopsin ist Retinal in der Netzhaut der meisten Wirbeltiere, einschließlich des Menschen, am Sehvorgang beteiligt. Bei dem neu entdeckten Protein Bacteriorhodopsin handelt es sich um eine lichtgetrie- bene Protonenpumpe. Mithilfe dieser Pumpe entsteht ein Gradient, ein Protonen- Konzentrationsgefälle zwischen innen und außen. Über die Membran hinweg wird auf diese Weise ein elektrisches Potenzial aufgebaut. Der Vorgang gleicht dem Laden einer Batterie. So wird das vom Retinal absorbierte Licht in elektrochemische Energie umgewandelt und in dieser Form vom Archaebakterium genutzt. Die Arbeiten von Dieter Oesterhelt und seinem Team zur Wechselwirkung von Licht mit Protein-Pigment- Komplexen schuf die Grundlagen für das heute als Optogenetik bekannte Gebiet.